- Нитрид титана
-
Нитрид титана 
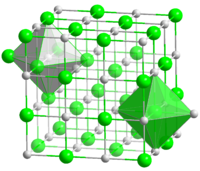
Общие Систематическое наименование мононитрид титана Традиционные названия нитрид титана Химическая формула TiN Физические свойства Состояние (ст. усл.) твёрдое Молярная масса 61,874 г/моль Плотность 5,44 г/см³ Термические свойства Температура плавления 2930 °C Молярная теплоёмкость (ст. усл.) 37,12 Дж/(моль·К) Теплопроводность (ст. усл.) 41,8 Вт/(м·K) Классификация Рег. номер CAS 25583-20-4 Регистрационный номер EC 247-117-5 Нитрид титана - бинарное химическое соединение титана с азотом. Представляет собой фазу внедрения с широкой областью гомогенности, которая составляет от 14,8 до 22,6 масс. % азота, что можно обозначить брутто-формулами от TiN0,60 до TiN1,0 соответственно[1].
Содержание
Физические свойства
Нитрид титана представляет собой порошок желто-коричневого цвета, а в компактном состоянии приобретает золотистую окраску. Имеет кубическую гранецентрированную решётку типа NaCl, пространственная группа Fm3m, с периодом а = 0,4235 нм.
- Удельное электрическое сопротивление 40 мкОм∙см
- Коэффициент линейного теплового расширения 9,35∙10−6 1/K (25-1100 °C)
- Микротвердость 2050 кг/мм2
- Модуль упругости 25600 кг/мм2[2]
Получение
Нитрид титана можно получить одним из следующих способов[1][3].
- Непосредственным насыщением титана азотом:
- Процесс азотирования проводят обычно при температуре выше 1100 °C в среде азота или диссоциированного аммиака. Для этой цели используют титан в виде порошка или стружки. Чистый порошок титана может быть заменен гидридом титана;
- Взаимодействием тетрахлорида титана со смесью азота и водорода:
- В основе этого способа лежит реакция:
- 2TiCl4 + 2NH3 = 2TiN + 6HCl + Cl2
- которую проводят при температуре выше 1000 °C. Так же нитрид титана можно осадить на вольфрамовую нить нагретую до температуры 1400—2000 °C;
- Разложением аминохлоридов титана:
- TiCl4•4NH3 → TiN + HCl + NH3
- Аминохлорид титана разлагается с образованием промежуточного продукта TiNCl, нагрев которого до температуры 1000 °C приводит к образованию чистого от хлора нитрида титана;
- Восстановлением оксида титана углеродом в среде азота:
- В основе процесса лежит реакция:
- 2TiO2 + 4C + N2 = 2TiN + 4CO
- С увеличение температуры процесса восстановления с 1000 °C до 1700 °C выход нитрида титана увеличивается, но при этом в продуктах реакции наблюдается появление карбида титана. Этот способ весьма пригоден для получения технически чистого нитрида титана в больших количествах, используемого для изготовления огнеупоров;
- Синтезом в плазме:
- Как исходный продукт для получения нитрида титана может быть использован TiCl4 или порошок титана, который подаю в струю плазмы генерируемую СВЧ-плазмотроном. Плазмообразующим газом является азот. Порошки полученные этим способом могут иметь размеры от 10 нм до 100 нм[4];
- Суть способа заключается в химической реакции титана с азотом, которая происходит с выделением тепла. Процесс ведут в герметическом реакторе, в котором процесс самопроизвольного горения инициируют нагревом контейнера заполненного азотом и порошком титана[5].
Химические свойства
Нитрид титана устойчив к окислению на воздухе до 700—800 °C, при этих же температурах сгорает в токе кислорода:
2TiN + 2O2 = 2TiO2 + N2
При нагреве до 1200 °C в среде водорода или в смеси азота и водорода нитрид титана является инертным веществом.
Нитрид титана стехиометрического состава проявляет стойкость к CO, но медленно реагирует с CO2 по реакции:
2TiN + 4CO2 → 2TiO2 + 4CO + N2
Реагирует на холоде с фтором:
2TiN + 4F2 = 2TiF4 + N2
Хлор не взаимодействует с нитридом титана до 270 °C, но реагирует с ним при температурах от 300 °C до 400 °C:
2TiN + 4Cl2 = 2TiCl4 + N2
При температуре 1300 °C хлороводород взаимодействует с TiN с образованием газообразных хлоридов титана и азота с водородом.
Взаимодействует с дицианом образуя карбонитрид титана[3]:
10TiN + (CN)2 = 2Ti5N4C + 2N2
При комнатной температуре, по отношению к серной, соляной, фосфорной, хлорной кислотам, а также к смесям хлорной и соляной, щавелевой и серной кислот, нитрид титана является стойким соединением. Кипящие кислоты (соляная, серная и хлорная) слабо взаимодействуют с TiN. На холоде малоустойчив против растворов гидроксида натрия. Взаимодействует с азотной кислотой, а в присутствии сильных окислителей растворяется плавиковой кислотой.
Нитрид титана является стойким к действию расплавов олова, висмута, свинца, кадмия и цинка. При высокой температуре сильно разъедается окислами железа (Fe2O3), марганца (MnO), кремния (SiO2) и стеклом[1].
Применение
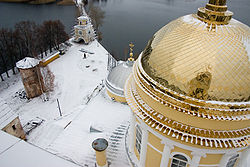 Купол Соборного храма во имя Богоявления Господня Ниловой пустыни, покрытый нитридом титана.
Купол Соборного храма во имя Богоявления Господня Ниловой пустыни, покрытый нитридом титана.
Применяется как жаропрочный материал, в частности из него делают тигли для бескислородной плавки металлов. В металлургии это соединение встречается в виде относительно крупных (единицы и десятки микрон) неметаллических включений в сталях, легированных титаном. Такие включения имеют, как правило, форму квадратов и прямоугольников, их легко идентифицировать методом металлографического анализа. Такие крупные частицы нитрида титана, образующиеся из расплава, приводят к ухудшению качества литого металла. Нитрид титана используется для создания износостойких покрытий (в частности, для зубных протезов жёлтого «под золото» цвета), используется в микроэлектронике в качестве диффузионного барьера совместно с медной металлизацией и др.
Нитрид титана применяется ещё и как износостойкое и декоративное покрытие. Изделия, покрытые им, по внешнему виду не отличаются от золота и могут иметь различные оттенки, в зависимости от соотношения металла и азота в соединении. Нанесение нитрида титана производится в специальных камерах термодиффузионным методом. При высокой температуре титан и азот реагируют вблизи поверхности покрываемого изделия и диффундируют в саму структуру металла.
См. также
Примечания
- ↑ 1 2 3 Самсонов Г. В. Нитриды. — Наукова думка, 1969. — С. 133-158. — 380 с.
- ↑ Самсонов Г. В., Виницкий И. М. Тугоплавкие соединения (справочник). — Металлургия, 1976. — С. 560.
- ↑ 1 2 Лучинский Г. П. Химия титана. — Химия, 1971. — С. 168-170. — 472 с.
- ↑ Краснокутский Ю. И., Верещак В. Г. Получение тугоплавких соединений в плазме. — Вища шк., 1987. — С. 134-139. — 200 с.
- ↑ Степанчук А. Н., Билык И. И., Бойко П. А. Технология порошковой металлургии. — Выща шк., 1985. — С. 169-170. — 415 с.
Категории:- Соединения титана
- Нитриды
- Имитации золота
Wikimedia Foundation. 2010.
